【适应症】
本品是一种menin抑制剂,用于治疗携带赖氨酸甲基转移酶2A基因(KMT2A)易位的的复发或难治性急性白血病的成人和1岁以上儿童患者。
【推荐剂量】
-根据 KMT2A 易位的存在情况选择接受本品治疗的患者。
-每天大约同一时间口服本品两次,空腹或与低脂餐一起服用。
-请参阅完整处方信息,了解推荐的本品给药方案、剂量调整和给药说明。
【不良反应】
最常见的不良反应(≥20%)包括实验室异常:出血、恶心、磷酸盐升高、肌肉骨骼疼痛、感染、天冬氨酸氨基转移酶升高、发热性中性粒细胞减少症、丙氨酸氨基转移酶升高、全段甲状旁腺激素升高、细菌感染、腹泻、分化综合征、心电图QT延长、磷酸盐降低、甘油三酯升高、钾降低、食欲下降、便秘、水肿、病毒感染、疲劳和碱性磷酸酶升高。
【使用方法】
1. 选择患者
根据骨髓细胞中 KMT2A 易位的存在情况,选择使用本品治疗急性白血病的患者。
2. 推荐剂量
本品的推荐剂量因患者体重和同时使用强效 CYP3A4 抑制剂而异。请参阅表 1 了解 1 岁及以上患者的推荐剂量。在白细胞减少到 25 Gi/L 以下之前不要开始使用本品。持续使用本品直到病情进展或出现不可接受的毒性。对于没有病情进展或不可接受的毒性的患者,治疗至少 6 个月以留出时间进行临床反应。
表1. REVUFORJ 针对 1 岁及以上患者的推荐剂量

*体重低于 40 公斤的患者按 BSA(体表面积)计算的药片总剂量请参见表 2。
表 2:体重低于 40 公斤的患者使用片剂的推荐剂量*
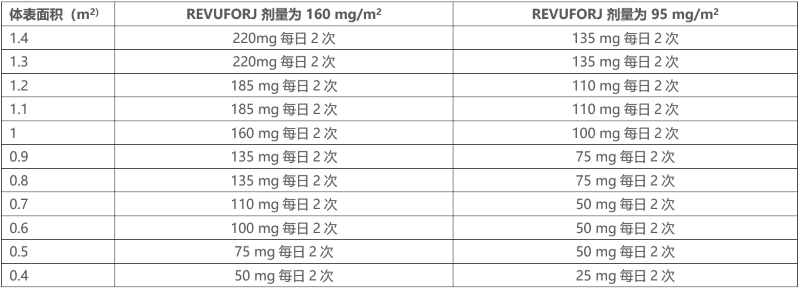
* 如果需要,可以组合不同规格的 REVUFORJ 片剂来达到所需剂量。
• 如果停用强效 CYP3A4 抑制剂,则在强效 CYP3A4 抑制剂至少 5 个半衰期后将本品剂量增加至未使用强效 CYP3A4 抑制剂时的推荐剂量(表 1)。
• 对于有中枢神经系统复发风险的患者,建议同时使用标准鞘内化疗预防。
给药:
• 每天两次空腹或与低脂餐(例如,约 400 卡路里、脂肪含量为 25% 或更少的餐食)一起服用本品。
• 每天大约在同一时间口服本品。
• 建议患者将药片整个吞下,不要切割或咀嚼药片。如果患者无法吞咽药片,可以将其压碎并分散在水中,并在制备后 2 小时内服用 。
【剂量调整】
不良反应的剂量调整
在开始本品之前以及之后每月评估血细胞计数、电解质和肝酶。在开始本品之前进行心电图 (ECG) 检查,前 4 周每周至少检查一次,之后每月至少检查一次。监测 QTc 间隔延长情况并及时处理任何异常情况。
根据表 3 中止用药或减少剂量。减少剂量的剂量水平列于表 4、表 5 和表 6。
表 3. 不良反应的推荐处理和剂量调整
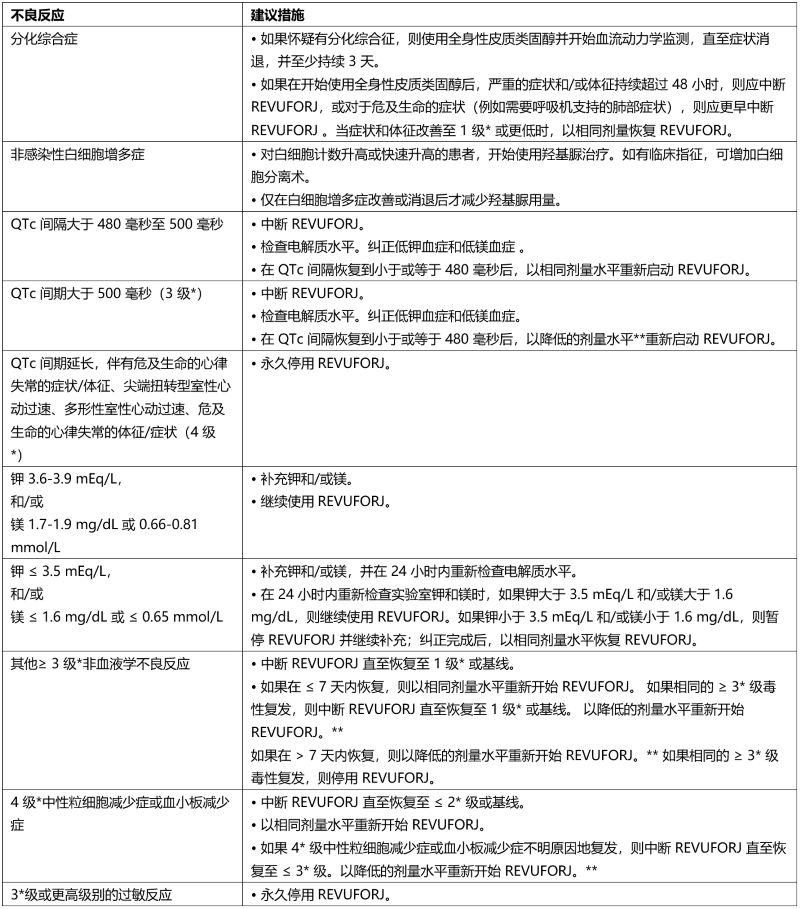
*1 级为轻度,2 级为中度,3 级为重度,4 级为危及生命。严重程度由美国国家癌症研究所不良事件常用术语标准 (NCI CTCAE 版本 5.0) 定义。
**请参阅表 4、5 和 6 了解降低的剂量水平。
表 4. 未使用强效 CYP3A4 抑制剂的患者发生不良反应时本品剂量减少

**请参阅表 6 中基于 BSA 的剂量建议,即每天两次减少剂量至 95 mg/m2。
表 5. 服用强效 CYP3A4 抑制剂的患者发生不良反应时本品剂量减少

*请参阅表 6 中基于 BSA 的剂量建议,将剂量减少至每天两次 65 mg/m2。
表 6:体重低于 40 公斤的患者使用片剂的推荐减少剂量*
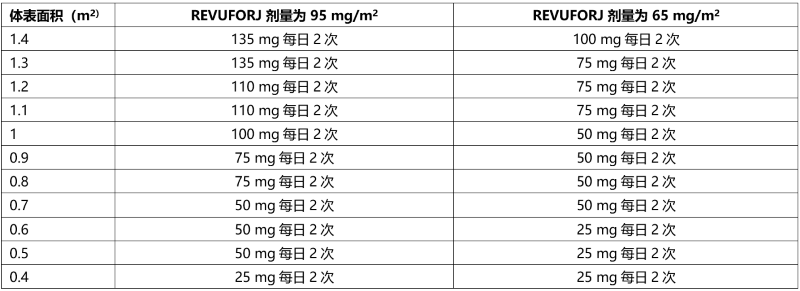
* 如果需要,可以组合不同规格的本品片剂来达到所需剂量。
【漏服处理】
如果错过 REVUFORJ 剂量或未在常规时间服用,请在同一天尽快服用该剂量,并且至少在下次预定剂量前 12 小时服用。第二天恢复正常时间表。请勿在 12 小时内服用 2 剂。
【过量处理】
无相关信息
【注意事项】
-QTc 间期延长:
监测心电图和电解质。在治疗前和治疗期间纠正低钾血症和低镁血症。如果发生 QTc 间期延长,请中断、减少或永久停用本品。
-胚胎-胎儿毒性:
可导致胎儿伤害。建议有育龄期女性和有生育能力的女性伴侣的男性注意对本品胎儿的潜在风险,并使用有效的避孕措施。
【禁忌】
无
【特殊人群】
-妊娠期:
根据动物研究结果及其作用机制,本品给孕妇服用时可能会造成胎儿伤害。
-哺乳期:
建议女性在使用本品治疗期间以及最终剂量后至少1周内不要母乳喂养。
-儿童:
本品对于患有 KMT2A 易位复发或难治性急性白血病的 1 岁及以上儿科患者而言,其安全性和有效性已经得到证实。
尚未确定本品对小于一岁的儿童患者的安全性和有效性。
-老年患者:
与年轻患者相比,没有观察到≥65岁患者在安全性或有效性方面的临床上重要的差异。与年轻患者相比,65 岁及以上患者的 QTc 延长和水肿发生率更高
【药物相互作用】
-强效 CYP3A4 抑制剂:
降低本品剂量。
-强效或中效 CYP3A4 诱导剂:
避免与本品同时使用。
-QTc 延长药物:
避免与本品同时使用。如果不可避免地同时使用,则应更频繁地监测患者的 QTc 间期延长情况。
【药理作用】
本品是一种menin抑制剂,可阻断野生型赖氨酸甲基转移酶 2A (KMT2A) 和 KMT2A 融合蛋白与menin的相互作用。KMT2A 融合蛋白与menin的结合通过激活白血病转录途径参与 KMT2A 重排 (KMT2Ar) 急性白血病。在使用表达 KMT2A 融合的细胞进行的非临床研究中,使用本品抑制menin-KMT2A相互作用会改变多个基因的转录,包括分化标志物。
在非临床体外和体内研究中,本品在含有 KMT2A 融合蛋白的白血病细胞中表现出抗增殖和抗肿瘤活性。
【贮藏】
存放在 20°C 至 25°C(68°F 至 77°F)的环境中;允许温度变化范围为 15°C 至 30°C(59°F 至 86°F)
- 产品名称:REVUFORJ
- 通用名称:revumenib
- 剂型:片剂
- 规格:160mg*30片;110mg*30片
- 生产厂家:SYNDAX PHARMACEUTICALS, INC.
请按药品说明书或在药师指导下购买和使用

 下载app
下载app