【适应症】
本品适用于成人癫痫患者局灶性发作的治疗。
【推荐剂量】
开始本品治疗前评估肝功能检查开始本品治疗前,如果近期(即 3 个月内)未曾检查血清转氨酶(ALT 和 AST)和总胆红素,则需进行相关检查,以确定肝功能基线值,请见注意事项章节。对于存在基线肝功能不全的患者,建议根据“肝功能不全患者的剂量推荐”调整给药剂量。
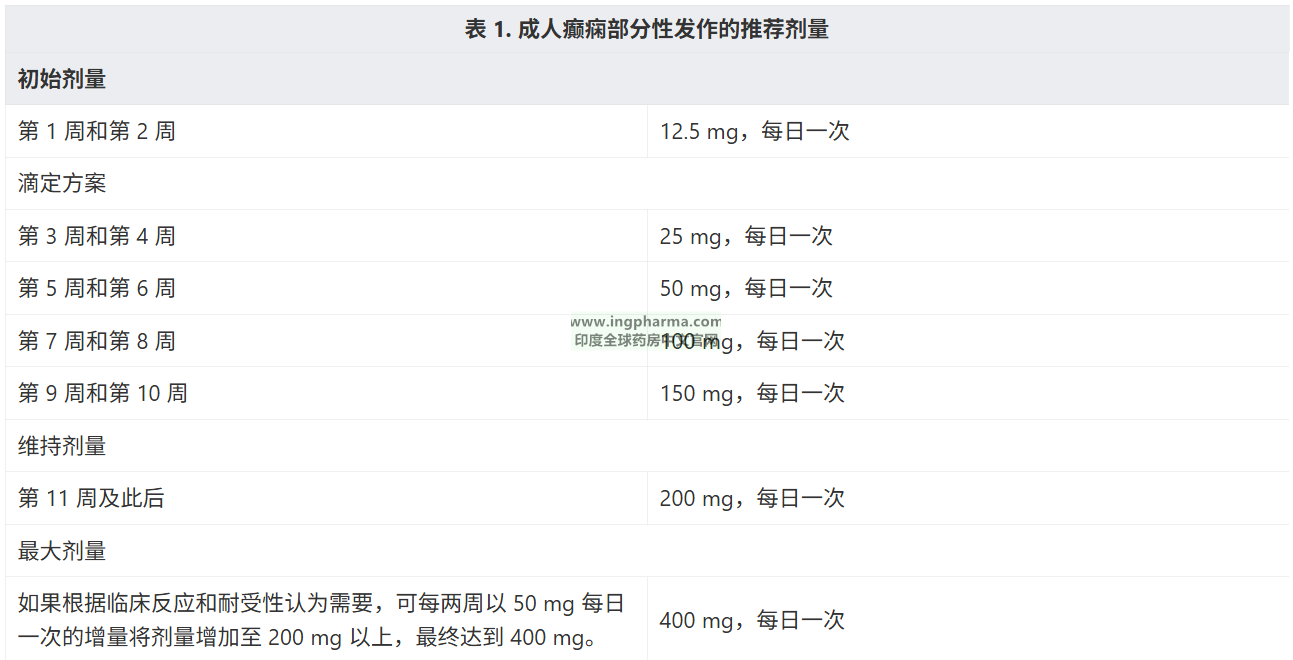
-剂量推荐单药治疗和添加治疗:
口服给药,每日一次,可与食物同时服用,也可单独服用。需遵循表 1 推荐的剂量和滴定方案,以避免药物过量可能导致的严重不良反应。
-肝功能不全患者的剂量:
推荐对于轻度至中度(Child-Pugh 分级 A 至 B)肝功能不全的患者,最大推荐剂量为 200 mg,每日一次。不建议重度(Child-Pugh 分级 C)肝功能不全患者服用本品。
【不良反应】
最常见不良反应(发生率至少为 10% 且高于安慰剂组)为嗜睡、头晕、疲劳、复视和头痛。
【使用方法】
-本品可整片服用,也可以碾碎服用。
-碾碎的片剂可与水混合,作为混悬剂口服或通过鼻胃管给药,如下所述。
碾碎的片剂作为混悬剂口服:
1. 将适当数量的片剂碾碎,以达到处方剂量。
2. 将碾碎的片剂和 25 mL 水在杯子中混合。
3. 搅拌至碾碎的片剂悬浮于水中,形成混悬液。
4. 混悬液请即刻饮用。请勿贮存该混悬液以备后用。
5. 为确保容器中无片剂残留,请用 25 mL 水冲洗容器并饮用。
6. 目视确认容器内无任何颗粒残留。如果仍有颗粒残留,请重复步骤 5。
碾碎的片剂通过鼻胃管给药:
1. 将适当数量的片剂碾碎,以达到处方剂量。
2. 将碾碎的片剂和 25 mL 水在适当的容器中混合。
3. 搅拌至碾碎的片剂悬浮于水中,形成混悬液。
4. 用注射器将混悬液注入鼻胃管中,确保容器中无颗粒残留。
5. 注射器中注入 10 mL 水,轻轻晃动,然后注入鼻胃管给药。
6. 目视确认注射器内无任何颗粒残留。如果仍有颗粒残留,请重复步骤 5。
【服用过量处理】
目前,关于人类过量服用本品的临床经验十分有限。
本品过量服用尚无特效解毒剂。若发生药物过量,应遵循药物过量处理的常规医疗原则。需确保患者气道通畅、供氧充足且通气正常;建议监测患者心率、心律及生命体征。
【注意事项】
-药物反应伴嗜酸粒细胞增多和全身性症状(DRESS)/多器官超敏反应:
服用本品的患者报告了药物反应伴嗜酸粒细胞增多和全身性症状(DRESS),也称为多器官超敏反应。在本品滴定过快(每周一次或更快滴定)时发生了 DRESS,包括 1 例死亡。在以 12.5 mg 每日一次开始给予本品,此后每两周滴定一次时,在 1339 名部分性发作癫痫患者中进行的开放性安全研究未报告 DRESS 病例。虽然该结果并不确定更慢滴定可防范 DRESS 风险;但建议应以 12.5 mg 每日一次剂量开始给予本品,然后每两周滴定一次。DRESS 典型症状(但不完全是)表现为发烧、皮疹、淋巴结病和/或面部肿胀,可伴有其他器官系统受累,例如肝炎、肾炎、血液学异常、心肌炎或肌炎(有时与急性病毒感染相似)。嗜酸粒细胞增多经常发生。这种疾病的表现多变,还可能累及此处未提及的其他器官系统。重要的是要注意超敏反应的早期表现(例如发热或淋巴结病),即使皮疹不明显。如果出现此类体征或症状应立即对患者进行评估。如果不能确定这些体征或症状的其它病因,则应立即停用本品且不可再使用。
-QT 间期缩短:
在一项考察 QT 间期的安慰剂对照研究中,与安慰剂组(6-17%)相比在服用本品的受试者(200 mg 组 31%,500 mg 组 66%)中发生 QT 间期缩短大于 20msec 的百分比更高。未观察到 QTc 间期缩短至 300msec 以下。家族性短 QT 间期综合征与猝死和室性心律失常(尤其是室颤)风险增加相关。该综合征背景下的此类事件主要发生在校正 QT 间期小于 300msec 时。非临床数据还表明 QT 间期缩短与室颤相关。家族性短 QT 间期综合征患者不应接受本品治疗。在将本品和其他缩短 QT 间期的药物联合给药时应谨慎,因为可能对 QT 间期产生协同效应从而增加 QT 间期缩短风险。
-自杀行为和想法:
患者服用抗癫痫药物(AED)包括本品,治疗任何适应症,可增加自杀想法或行为的风险。对于服用任何 AED 治疗任何适应症的患者,应监测抑郁、自杀想法或行为的出现或恶化以及/或者情绪或行为的任何异常变化。对 11 种不同 AEDs 的 199 项安慰剂对照临床试验(单药和添加治疗)进行汇总分析,结果显示,随机给予其中一种 AED 的患者发生自杀想法或行为的风险(调整后相对风险 1.8,95%CI:1.2,2.7)大约是随机给予安慰剂的患者的两倍。从中位治疗持续时间为 12 周的这些试验中发现,27,863 例 AED 治疗患者的自杀行为或想法的估计发生率为 0.43%,而 16029 名安慰剂治疗患者为 0.24%,意味着每 530 名治疗患者中大约增加 1 例自杀想法或行为。在试验中用药患者发生 4 例自杀,在安慰剂患者无自杀,但事件数量过少,无法得出关于药物对自杀影响的任何结论。
AED 引起自杀想法或行为风险的升高在开始 AED 治疗后 1 周内就能观察到,并在治疗期间持续。由于本次分析中包含的大多数试验的治疗时间均未超过 24 周,因此没有评价 24 周后自杀想法或行为的风险。在此数据分析中,自杀想法或行为的风险在药物之间一致。对于各种作用机制、各种适应症的 AEDs 药物发现到的风险升高的现象说明此风险适用于任何适应症的所有 AEDs。在所分析的临床试验中该风险没有随年龄(5-100 岁)发生大幅变化。
-肝功能不全:
境外上市后监测数据显示,接受本品治疗的患者中曾报告具有临床意义的肝损伤病例。患者用药后曾出现肝损伤的指征,包括血清肝转氨酶显著升高伴总胆红素升高。境外上市后监测中,曾报告需进行肝移植治疗的急性肝衰竭病例。在临床试验中,接受本品治疗的患者曾出现血清肝转氨酶升高现象。开始本品治疗前,如果近期(即 3 个月内)未检测,应检测血清转氨酶(ALT 和 AST)和总胆红素以获取肝功能基线值。治疗期间需监测肝损伤体征和症状,对于出现提示肝功能障碍临床体征或症状(如不明原因的恶心、呕吐、右上腹腹痛、疲劳、厌食、黄疸、小便黄赤)的患者,应及时检测血清 ALT、AST 和总胆红素水平。对于出现肝损伤且无其他病因的患者,应中断或终止本品治疗。血清肝转氨酶升高超过参考值范围上限 3 倍且总胆红素升高超过参考值范围上限 2 倍是预测重度肝损伤的重要指标。早期识别血清肝转氨酶和总胆红素升高并及时中断或终止本品治疗,可降低出现严重结局的风险。
-神经系统不良反应:
1)嗜睡和疲劳
本品可使嗜睡和疲劳相关不良反应(嗜睡、疲劳、虚弱、不适、睡眠过度、镇静和昏睡)发生剂量依赖性增加。在研究 1 和研究 2 中,本品 100 mg/天、200 mg/天和 400 mg/天随机治疗组分别有 31%、36% 和 57% 的患者报告了至少一例上述不良反应,相比之下安慰剂组有 19% 患者报告。0.4% 的治疗组患者和 0% 的安慰剂组患者发生严重的嗜睡和疲劳相关不良反应、2% 的治疗组患者和 1% 的安慰剂治疗组患者因这些反应停药。
2)头晕以及步态和协调障碍
本品可引起与头晕、步态和协调障碍相关的剂量依赖性不良反应(头晕、眩晕、平衡障碍、共济失调、眼震、步态障碍和协调功能失常)。在研究 1 和研究 2 中,本品100 mg/天、200mg/天和 400mg/天随机治疗组分别有 21%、31% 和 52% 患者报告了至少一例上述不良反应,相比之下安慰剂组有 18% 患者报告。2% 的治疗组患者和 0% 的安慰剂组患者发生严重的头晕、步态和协调障碍不良反应、5% 的治疗组患者和 1% 的安慰剂组患者因这些反应停药。
3)认知功能障碍
本品可引起与认知功能障碍相关事件相关的不良反应(如,记忆受损、注意障碍、失忆症、意识模糊状态、失语、言语障碍、思维迟缓、定向障碍和精神运动性阻滞)。在研究 1 和研究 2 中,本品 100mg/天、200mg/天和 400mg/天随机治疗组分别有 6%、6% 和 9% 患者报告了至少一例上述不良反应,相比之下安慰剂组中有 2% 的患者报告。本品治疗组患者或安慰剂组患者均未发生严重的认知功能障碍相关事件。0.4% 的治疗组患者因为认知功能障碍相关不良反应而停药,相比之下安慰剂组无患者因此停药。
4)视觉变化
本品可引起与视觉变化相关的不良反应,包括复视、视物模糊和视觉受损。在研究 1 和研究 2 中,本品 100mg/天、200mg/天和 400mg/天随机治疗组分别有 9%、9% 和 18% 的患者报告了至少一例上述不良反应,相比之下安慰剂组中有 2% 的患者报告。治疗组或安慰剂组患者均未发生严重的视觉变化相关事件。0.5% 的治疗组患者因为视觉变化而停药,相比之下安慰剂组无患者因此停药。
5)风险防范
处方者应建议患者在明确知晓本品的效应之前,不要从事需要精神高度警觉的危险活动,如驾驶机动车辆或操纵危险机器。当本品与其他具有镇静作用的药物联合使用时,鉴于潜在的累加效应需仔细观察患者是否出现中枢神经系统(CNS)抑制的体征,如嗜睡和镇静。
-抗癫痫药物的停药
与大多数抗癫痫药物相同,本品通常应逐渐停药,否则可能造成癫痫发作频率增加和导致癫痫持续状态的风险。但如果因为严重不良事件而需要停药,可以考虑快速停药。
【禁忌】
本品禁用于下列患者:
-对本品或本品中的任何非活性成分过敏
-家族性短 QT 间期综合征
【特殊人群】
-怀孕:
基于动物实验数据,本品可能对胎儿造成伤害。
-哺乳:
目前没有发现母乳中存在本品,应该综合考虑母亲对药物的需要以及药物对婴儿的潜在不良影响,来决定是否使用本品。
-老年用药:
本品的临床研究并未包括足够多的65岁及以上的患者来确定本品在老年人群中的安全性和有效性。通常,老年患者的剂量选择应谨慎,通常从给药范围的低端开始。
-肾功能不全:
轻度至中度肾功能不全患者(肌酐清除率 30~<90 mL/min)需慎用,且可考虑减量;重度肾功能不全患者(肌酐清除率<30 mL/min)同样需慎用并考虑减量。终末期肾病(肌酐清除率<15 mL/min)接受透析治疗的患者,不推荐使用本品
-肝功能不全:
轻度至中度肝功能不全患者需慎用,应降低最大给药剂量,且可考虑进一步减量。重度肝功能不全患者,不推荐使用本品。
【药物相互作用】
1、临床研究
-酒精
在合并给药时,未观察到本品或酒精的药代动力学存在具有临床意义的差异。
-AED
在多次合并给予本品 200 mg 每日一次时,苯妥英的平均 Cmax和 AUC 分别升高 70% 和 84%、苯巴比妥的平均 Cmax和 AUC 分别升高 34% 和 37%。在多次合并给予本品 200 mg 每日一次时,卡马西平的平均 Cmax和 AUC 都降低 23%。在与本品合并用药时,未观察到下列药物的药代动力学存在具有临床意义的差异:丙戊酸、左乙拉西坦或拉考沙胺。基于群体 PK 分析,在使用 100-400 mg/天剂量的本品治疗时,预期拉莫三嗪浓度将降低 21-52%;预期左乙拉西坦的浓度将降低 4-13%,不具有临床意义。对于在研究 1 和研究 2 中接受本品治疗的受试者,有效性与合并用药奥卡西平之间无明确关系。因此,研究 1 和研究 2 的有效性数据不支持本品对奥卡西平产生与临床相关的相互作用。
-CYP 底物
在多次合并给予本品 200 mg 每日一次时,安非他酮(CYP2B6 底物)平均 Cmax 和 AUC 分别降低 23% 和 39%、咪达唑仑(CYP3A 底物)平均 Cmax和 AUC 分别降低 61% 和 72%。在多次合并给予本品 200 mg 每日一次时,奥美拉唑(CYP2C19 底物)的平均 Cmax和 AUC 分别升高 83% 和 107%。在与本品合并用药时,未观察到华法林(CYP2C9 底物)的药代动力学存在具有临床意义的差异。
-合并用药 AED 对本品 PK 的影响
在与苯妥英联合用药时,本品多次给药的血浆暴露量(Cmax、AUC)降低 27-28%。然而,丙戊酸、苯巴比妥和卡马西平重复给药对本品多次给药的血浆暴露量未产生任何显著影响。
2、体外研究
-CYP 酶
本品可抑制 CYP2B6、CYP2C19 和 CYP3A,但不抑制 CYP1A2、CYP2C8、CYP2C9 或 CYP2D6。本品可诱导 CYP2B6、CYP2C8 和 CYP3A4,但不诱导 CYP1A2、CYP2C9 或 CYP2C19。
-转运蛋白系统
本品不是 P-gp、BCRP、OAT1、OAT3、OCT2、MATE1 或 MATE2-K 的底物,本品也不会抑制 P-gp、OAT1、OCT1、OCT2、OATP1B3、BSEP、OAT3 或 OATP1B1。
【药理作用】
西诺氨酯在部分性发作癫痫患者中发挥治疗作用的确切机制尚不明确。已证实西诺氨酯可通过抑制电压门控钠电流来减少神经元重复放电,同时也是γ-氨基丁酸(GABAA)离子通道的正向变构调节剂。
【贮藏】
20°C至25°C(68°F至77°F);将药物放在儿童和宠物接触不到的地方。
- 产品名称:LuciCeno
- 通用名称:Cenobamate
- 剂型:片剂
- 规格:12.5mg*30片; 50mg*30片 ;200mg*30片
- 生产厂家:老挝卢修斯制药Lucius
请按药品说明书或在药师指导下购买和使用

 下载app
下载app